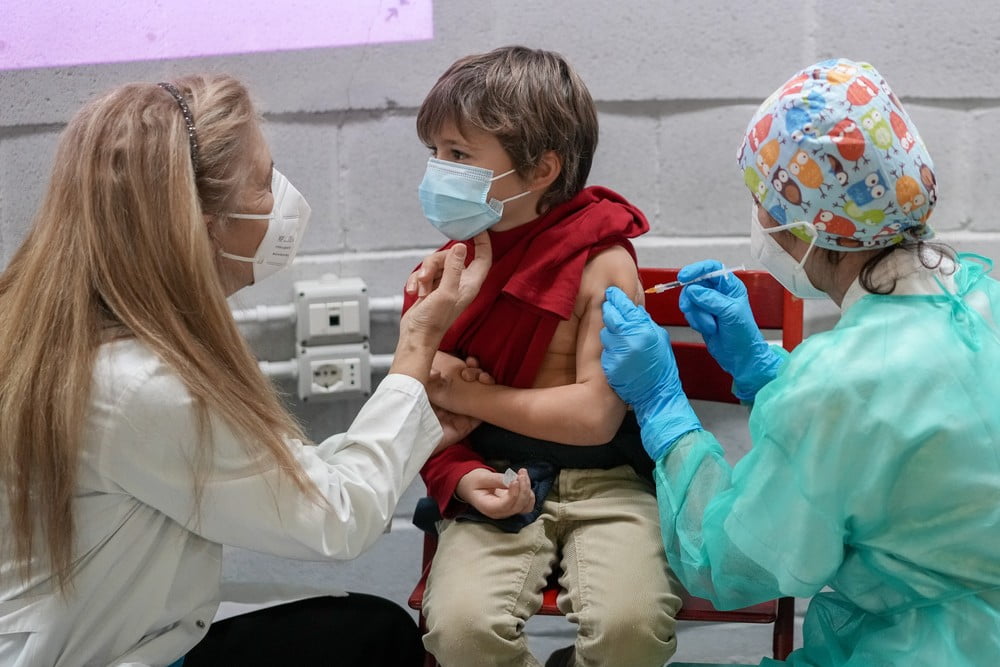
A área técnica da Agência Nacional da Vigilância Sanitária (Anvisa) autorizou nesta quinta-feira (16), a aplicação da vacina Pfizer contra a Covid-19 em crianças de 5 a 11 anos. Ainda não há previsão para quando a vacina começara a ser aplicada, pois a dosagem para esse público será menor do que a utilizada por maiores de 12 anos e o Brasil ainda não tem as doses ajustadas. Mais de 10 países já iniciaram a vacinação de menores de 12 anos.
Em outubro, a Pfizer disse que a vacina é segura e mais de 90,7% eficaz na prevenção de infecções em crianças de 5 a 11 anos.
A Anvisa alerta que a autorização é baseada em dados disponíveis até o momento e os resultados são avaliados a todo momento.
Veja as orientações da agência:
- A dose para as crianças entre 5 e 11 anos de idade é de 1/3 em relação à formulação já aprovada no Brasil
- Formulação pediátrica é diferente daquela aprovada anteriormente apresentada para o público com mais de 12 anos e, portanto, não pode ser utilizada a formulação de adultos diluída
- A criança que completar 12 anos entre a primeira e a segunda dose, deve manter a dose pediátrica
- Não há estudos sobre a coadministração com outras vacinas – não deve ser administrada com outras vacinas
Além da área técnica, também participaram da avaliação especialistas das sociedades brasileiras de Infectologia (SBI), de Imunologia (SBI), de Pediatria (SBP), de Imunizações (SBIm) e de Pneumologia e Tisiologia.
Dosagem menor
O pedido para a aplicação nesta faixa etária foi apresentado pela Pfizer em 12 de novembro. A farmacêutica informou que a dosagem para essa faixa etária será menor. Além disso, os fracos de vacina terão as tampas na cor laranja, para diferenciar das doses já utilizadas em maiores de 12 anos.
“A redução na dosagem para a faixa de 5 a 11 anos se respaldou nos estudos de Fase 1 e 2, que mostraram que essa dosagem (10 microgramas) foi o suficiente para gerar altos títulos de anticorpos com perfil de segurança bastante favorável para a população pediátrica”, informou a Pfizer.
A avaliação levou 21 dias, descontados os 14 dias que a Pfizer utilizou para responder as exigências técnicas da Anvisa. O tempo total do processo na agência foi de 35 dias.